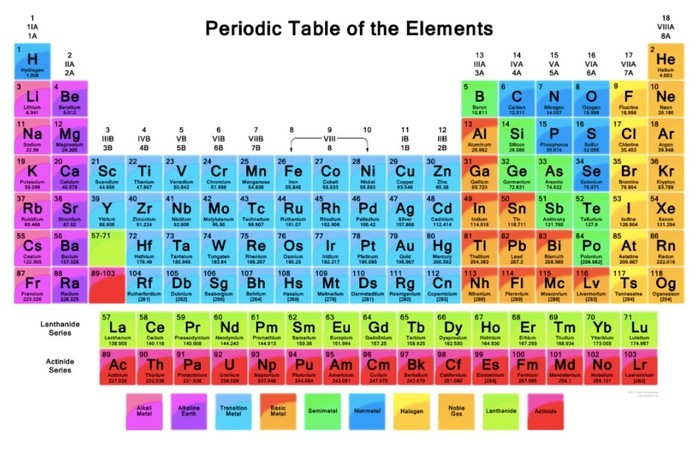
Tabel periodik adalah tabel yang menampilkan setiap unsur kimia dalam setiap sistemnya. Unsur-unsur kimia tersebut memiliki jumlah yang sangat banyak, dengan sifat yang berbeda-beda, antara satu dengan unsur yang lainnya.
Tujuan dibuatnya tabel periodik unsur adalah untuk mengenal nama unsur dari partikel kimia secara mudah melalui pengelompokan.
Mengutip modul Kimia Kelas X oleh Fadillah Okty Myranthika, M.Pd, sistem periodik juga diartikan sebagai susunan yang menampilkan berbagai unsur kimia berdasarkan nomor atom dan kesamaan sifat kimianya.
ADVERTISEMENT
SCROLL TO CONTINUE WITH CONTENT
Dalam pengelompokan tabel periodik, sifat fisik dan sifat kimia dari setiap unsur-unsur tersebut telah dituangkan oleh para ahli kimia dalam bentuk tabel unsur.
Adapun fungsi tabel periodik unsur adalah untuk membantu mengetahui nomor atom, konfigurasi elektron, dan mempelajari setiap sifat-sifat unsur beserta keteraturannya.
Pada tabel sistem periodik, akan ditemukan golongan dan periode di suatu lajur. Golongan adalah lajur tegak atau baris vertikal pada sistem periodik. Sedangkan, periode adalah lajur mendatar atau baris horizontal.
Sejarah Perkembangan Sistem Periodik Unsur
Pengelompokan unsur-unsur berdasarkan kemiripan sifat mengalami perkembangan dari yang paling sederhana hingga modern. Mulai dari Antoine Lavoisier hingga mengalami penyempurnaan oleh Henry Moseley, seorang kimiawan asal Inggris yang menemukan cara menentukan nomor atom.
Dalam buku "Kimia" karya Nana Sutresna dijelaskan bahwa pada tahun 1913, Moseley telah melakukan eksperimen pengukuran panjang gelombang unsur menggunakan sinar-X.
Eksperimen Moseley itu telah membuat kesimpulan bahwa sifat dasar atau bukanlah didasari oleh massa atom relatif, melainkan didasari oleh kenaikan jumlah protonnya, yang diakibatkan dari adanya unsur-unsur yang memiliki massa atom berbeda, tetapi memiliki jumlah proton yang sama yang disebut isotop.
Ikatan jumlah proton tersebut telah mencerminkan kenaikan nomor atom unsur. Sehingga, sifat-sifat unsur merupakan fungsi periodik dari nomor atomnya.
Pengelompokan unsur-unsur sistem periodik modern merupakan penyempurnaan hukum periodik Mendeleev yang disebut juga tabel periodik bentuk panjang.
Dalam pandangan ini, penyusunan sistem periodik modern didasarkan pada kenaikan atom dan kemiripan sifatnya.
Sistem periodik modern sendiri terdiri atas 7 periode. Periode terbagi menjadi 2 jenis yakni, periode panjang (4,5,6, dan 7) dan periode pendek (1, 2, dan 3).
Jumlah golongan pada sistem periodik terdiri atas 8 golongan utama (golongan A) dan 8 golongan tambahan (golongan B). Unsur-unsur golongan B disebut dengan unsur transisi. Letak unsur golongan B berada di antara golongan IIA dan IIIA.
Gambar Tabel Periodik Unsur Kimia
Agar lebih jelas memahami, detikers bisa melihat tabel sistem periodik di bawah ini.
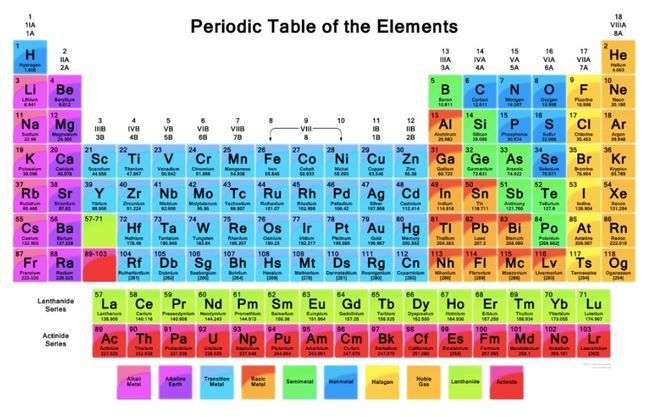 Gambar Tabel Periodik Unsur Kimia. Foto: dok. modul belajar Kemdikbud Gambar Tabel Periodik Unsur Kimia. Foto: dok. modul belajar Kemdikbud |
Sifat Keteraturan Tabel Periodik
Dalam tabel periodik, akan ditemukan angka-angka dengan keteraturan sifat unsur berdasarkan jari-jari atom, keelektronegatifan, energi ionisasi, logam dan non-logam dan juga afinitas elektron.
Untuk bisa membaca dan memahami tabel periodik, ada baiknya detikers memperhatikan istilah-istilah di bawah ini:
1. Jari-jari atom
Jari-jari atom adalah jarak dari inti atom sampai kulit terluar suatu atom. Secara periodik, jari-jari atom akan cenderung semakin besar dalam satu golongan dari atas ke bawah. Hal itu disebabkan karena bertambahnya nomor atom beserta kulit elektron dalam satu golongan.
Dalam satu periode, dari kiri ke kanan jari-jari atom cenderung semakin kecil, sebagaimana muatan inti efektif. Bertambahnya jumlah proton dalam muatan inti efektifnya, makin besar pula gaya tarik inti terhadap elektron terluar.
2. Energi Ionisasi
Ionisasi merupakan energi untuk melepaskan elektron yang terikat paling lemah oleh suatu atom atau ion dalam wujud gas. Secara periodik, dalam satu golongan, dari atas ke bawah, energi ionisasi semakin kecil dalam satu periode, dari kiri ke kanan, energi ionisasi cenderung bertambah.
Energi ionisasi bergantung pada elektron yang akan dilepaskan, yakni besar gaya tarik inti terhadap elektron kulit terluar.
3. Afinitas Elektron
Besarnya energi yang dihasilkan atau dilepaskan pada suatu atom yang menarik sebuah elektron disebut afinitas elektron.
Secara periodik, dalam satu golongan dari atas ke bawah, afinitas elektron cenderung berkurang (semakin kecil) dari kiri ke kanan sampai golongan VII A, dan cenderung bertambah (semakin besar) kecuali unsur alkali tanah dan gas mulia.
Semua unsur golongan utama mempunyai afinitas elektron bertanda negatif, di mana unsur golongan terbesarnya dimiliki oleh golongan halogen. Semakin negatif nilai afinitas elektron, maka semakin besar kecenderungan atom atau ion menerima elektron (afinitas terhadap elektron semakin besar).
4. Elektronegativitas
Elektronegativitas atau keelektronegatifan merupakan kecenderungan suatu atom menarik pasangan elektron dalam membentuk ikatan. Unsur yang memiliki energi ionisasi dan afinitas elektron yang besar, akan membuat keelektronegatifan semakin besar.
Secara periodik, dalam satu golongan, dari atas ke bawah, elektronegativitas cenderung akan semakin kecil, sedangkan dari kiri ke kanan dalam satu periode, cenderung semakin besar sehingga membuat penarikan atom akan semakin mudah. Harga keelektronegatifan dapat diukur dengan skala Pauling, antara 0,7 (Fr) - 4,0 (Fr).
5. Logam dan Non-logam
Sifat logam dan non logam merupakan kecenderungan atom untuk melepas elektron dan membentuk ion bermuatan positif (tergantung dengan energi ionisasi).
Sifat logam berkaitan dengan keelektropositifan. Semakin besar energi ionisasinya, maka sifat logamnya akan berkurang, karena sulit melepas elektron. Sementara itu, sifat non logam berkaitan dengan keelektronegatifan, yakni kecenderungan atom untuk menyerap elektron.
Kecenderungannya melepas atau menarik suatu elektron disebut dengan kereaktifan. Unsur logam yang paling reaktif adalah golongan IA.
Unsur non-logam paling reaktif berada pada golongan VIIA (lihat sifat logam dan non logam), di mana golongan VIIIA (gas mulia) tidak reaktif.
Secara periodik dalam satu golongan dari atas ke bawah kecil, dan dalam satu periode dari kiri ke kanan mula-mula menurun, dan akan bertambah hingga golongan VIIA.
Simak Video "4 Fenomena Gerhana yang Bakal Terjadi di 2024"
[Gambas:Video 20detik]
(faz/faz)